Estérification-Hydrodistillation
I) Qu'est ce qu'un esters :
1) Molécule
La formule de
l'ester est :
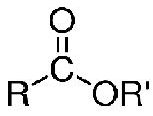
où R est un atome d'hydrogène ou une chaîne carbonée et R' est une chaîne carbonée Un ester est le produit de la réaction entre un acide carboxylique et un alcool.
  |
| Acide carboxylique Alcool Ester Eau |
On retrouve donc dans la formule d'un
ester un groupe
d'atomes venant
de l'acide carboxilique ( groupe carboxylate :
R-COO-) et un groupe
alkyre R' venant de l'alcool R'-OH.
Un ester se présente donc comme un carboxylase d'allyle, la
nomenclature s'en déduit.
Nomenclature
:
Le nom de l'ester est issu des noms de l'acide
carboxylique et de
l'alcool
formant l'ester.
| Famille | Acide | Alcool | Alcool |
| Nom | acide propanoïque | méthanol | propanoate de méthyle |
| Formule | CH3-CH2-CO-OH | CH3-OH | CH3-CH2-CO-O-CH3 |
Le 1er terme est obtenu avec le nom de l'acide en changeant le « oïque » en « oate ».
Le 2eme terme est obtenu avec le nom de l'alcool en changeant le « anol » en « yle ».
2) Propriétés des esters :
Les esters sont souvent liquides (à pression et température usuelles), assez volatils, à odeur fruitée et très peu solubles dans l'eau (contrairement aux acides et aux alcools dont ils dérivent).
A l’état naturel, on les trouve dans les essences d’origine végétale utilisées dans les parfums.
II) Estérification et hydrodistillation de l'ester:
1) Équation de la réaction :
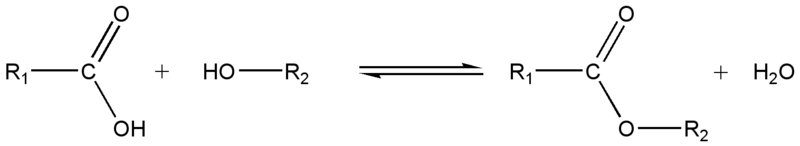
L'estérification est la réaction entre un acide carboxylique R-COOH et un alcool R’-OH conduisant à la formation d’un ester R-COO-R’ et d’eau. ( la réaction inverse s'appelle l'hydrolyse (cf définition))
Équation :

L'Hydrodistillation consiste à entraîner les parfums de la plante par de la vapeur d'eau. On obtient ensuite un distillat que l'on traite. Ce procédé est d'origine arabe et est très ancien.
2) Propriétés des réaction d'estérification et d'hydrodistillation de l'ester :
Ces deux réactions sont lentes, limitées et athermiques (elles ne nécessitent pas d'énergie et ne dégagent pas d'énergie ).
3) Étude expérimentale :
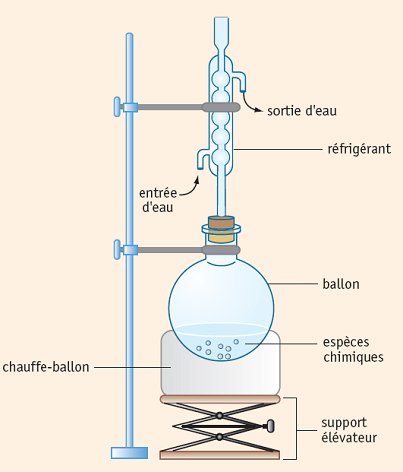
1) Par chauffage à reflux :
Préparation d'un ester très fruité, mais aussi constituant actif de la phéromone d'alarme de l'abeille : l'éthanoate de 3-méthylbutyle.
Pour cela :
Introduire 10,6 mL (100 mmol) de 3-méthylbutan-1-ol, 23 mL (400 mmol) d'acide éthanoïque et un barreau aimanté dans un ballon. Ajouter 2 mL d'acide sulfurique concentré, mettre l'agitation en marche et chauffer à reflux pendant 2 heures.
En
utilisant un
réactif (l'acide éthanoïque) en
excès on
déplace l'équilibre vers la formation de
l'ester
(loi de modération).L'acide sulfurique
joue le
rôle de catalyseur.
la
température est
un facteur cinétique : la vitesse de la
réaction sera augmentée.
Le réfrigérant condense les vapeurs : celles ci retombent dans le ballon et il n'y a pas de pertes de matière lors du chauffage.
L’équation de l’estérification est la suivante :
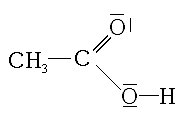 + +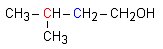 +
+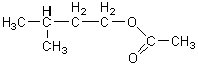 |
| acide
éthanoïque
3-méthylbutan-1-ol
(Alcool) éthanoate
de 3-méthylbutyle (Ester)
|
1) Par Hydrodistillation :
Préparation d'une huile essentiel de clou de girofle par hydrodistillation :
Pour cela :
Introduire dans un ballon de l'eau distillé et du clou de girofle. Faire chauffer a l'aide du chauffe ballon.
Le réfrigérant condense les vapeurs : celles ci retombent dans le ballon et il n'y a pas de pertes de matière lors du chauffage.
Photos de la manipulation :

Manipulation dés le commencement ( température 20°C)

Observation au bout de 10 minutes (température 80°C). De la buée se forme dans le ballons.

Observation au bout de 15 minutes (température 100°C). De la vapeur s'est échappée du ballon et se condense et retombe dans le bêcher. ( Il se trouve dans le bêcher de l'huile essentiel de clou de girofle ).